在这个炎炎夏日,医疗器械行业发展的坚冰似乎有消融的痕迹。
“最近两年,我们的大型治疗设备终于开始进入国内的三甲医院了,这在以前是不敢想象的。”深圳一家生产高端医疗设备的企业人士在对《第一财经日报》记者谈起行业变化时,唏嘘中带着欢喜。
在国内三甲医院,国产的高端医疗器械产品占有率不高。虽然暂无官方统计数据,但是据多位业内人士观察,50%以上的中端产品依靠国外进口,高端的进口率甚至高达90%以上。
我国医疗器械行业以生产中低端产品为主;高端产品则由于技术、资金和回报期漫长等问题,发展缓慢。
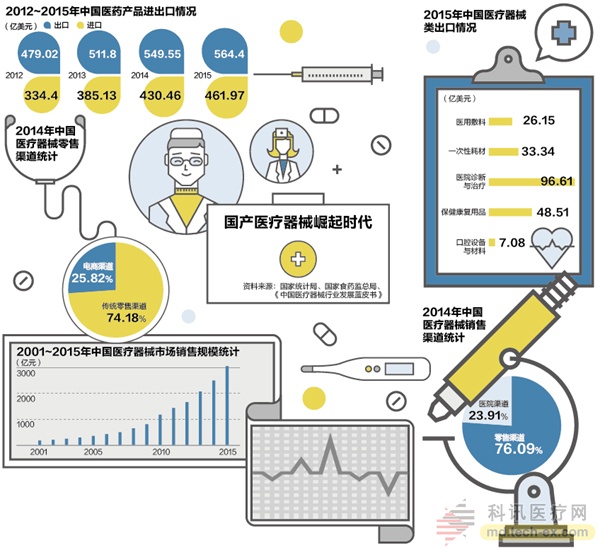
2015年,我国医疗器械出口额达到211.7亿美元,增幅5.73%,但是出口产品仍以一次性医用耗材、医用敷料、按摩器具和中低端诊疗器械为主。高值耗材、CT机、磁共振仪和植入性医疗器械等高端产品仍以进口为主。
不过,近年来随着一系列利好政策的出台,一大批医疗器械企业强势崛起,开始进入国内中高端市场。该行业也因此正逐步向中高端的价值链上游转移,实现进口产品替代。
与此同时,国家对医疗器械行业的监管也日趋严格。可以预见的是,大量中小生产企业面临着行业洗牌,优势资源和市场将进一步集中到资金实力雄厚的企业。
外资品牌地位难撼动
珠三角是医疗器械生产企业重要的集中地之一。相比于前文中生产治疗设备的企业,王筱毅的公司生产的经颅多普勒(TCD)等神经科产品是诊断设备,人体使用的风险没那么高,进驻三甲医院更早一些,“大概是在2009年以后吧”。他告诉《第一财经日报》记者:“现在,三甲医院是我们的主要用户。”
王筱毅是深圳市德力凯医疗设备股份有限公司的负责人。该公司与TCD发明人Rune Aaslid联合研发,有6项发明专利,已于2011年获得国家科技部火炬计划立项。
虽然他们早在2009年左右就进驻了三甲医院,但是对于这家成立于1998年的企业来说,过程甚至可以说漫长。
目前,他们的TCD除了进入国内的三甲医院,还出口至美国、德国和韩国等多个国家。去年营业收入近3000万元。今年,由于新产品的上市,销售收入预计还会有较大幅度的增长。
即便是这些生产中高端的国产医疗器械开始崛起,外资品牌在国内的市场垄断地位短期内也难以撼动。
全国最大的医疗器械生产企业——深圳迈瑞生物医疗电子股份有限公司公关总监茅伟明告诉记者,医疗器械是西方医学的辅助工具,外资品牌在该领域优势较大。从细分市场来看,强生是植入性医疗器械的巨头,通用、飞利浦和西门子是诊断器械行业的老大,占到国内高端市场的80%以上,而在检验设备领域,前三家外资品牌也占据70%以上的国内高端市场份额。
他说:“局面改观需要时间。这是一个市场积累的过程,刚刚启动。另外,高端产品的采购方不缺钱,没必要冒着一定的风险,为了性价比选择国产产品。”
国内医疗器械行业问题多
茅伟明补充道,国内能够称高端产品的不多,有些号称技术可以比肩国外的,产品品质也未必过关。
上海证券医疗行业分析师杜臻雁告诉《第一财经日报》记者,技术上,现在有一些小的子行业其实已经跟国外旗鼓相当了,但在一些大型的影像诊断设备上还是跟国外有一定差距。
除了技术与品质,国内整个医疗器械业仍然面临着规模过小的问题。
根据天星资本今年4月底发布的报告,从营业收入增速和净利润增速情况看,目前103家医疗器械挂牌企业具有较高的成长性,但是规模普遍较小。
尽管深圳的医疗器械行业发展迅速,在国内具有一定的领先优势,但本报记者拿到的一份行业报告显示,这里的生产企业平均产值仅在4000万元左右;上亿元的只有三四十家,4000万元以下的则多达数百家。这与国际巨头动辄上百亿的产值难以匹敌。
“乱”也是国内医疗行业的另一个关键词。深圳医疗器械行业协会的一位负责人张晓华告诉记者,为了解决租金太贵和工人难招的问题,上次他带领几位深圳的企业主到外地去考察一个模范产业园,打算在当地设厂。当时他们去一家企业参观,待不了5分钟就出来了,“质量管控不行,管理混乱”。
医疗器械行业与整体工业水平相关
冰冻三尺非一日之寒。
医疗器械的应用基础是西医学,而中国的传统医学理论是中医学。自中国在近代引入医疗器械后,产业基础受制于国外,一直较为薄弱。
此外,医疗器械与电子和机械等行业有所不同。后两者均是以技术领域来划分,比如说收音机属于电子行业,以电子学为基础,技术领域相对固定。而医疗器械是以应用来划分,技术领域不固定,涉及面很宽泛。这意味着,医疗器械水平的高低和整体工业水平密切相关。
水平不仅仅体现在核心技术,更涉及种种细节。“以前我们和医生交流,他们打比方说,你们机器性能很好,但是开关不好。”张晓华告诉记者:“医生会觉得,我在做手术的过程中,心思本来应该放在病人的病理研究上。如果你们的设备细节不完善,会扰乱他的注意力”。
一位医生告诉本报记者,他对国产治疗设备并无偏见,但在使用时会更慎重。
他说:“设备不是问题,但是如果本身材料有问题呢?比如说,测温电偶材料有杂质,是否会影响传输数据?是否会引发连锁反应,比如说接触不良?”
他补充道:“这些涉及化工材料的制造,很复杂,而国内在这个领域的历史经验欠缺,还需要仰赖外国经验。但手术事关人命,容不得有丝毫的顾虑和疏漏。”
医院“崇洋”观念难改
这位医生的观念在很多大型医院普遍存在,短时间难以扭转。即使一些国产医疗器械的技术水准与国外品牌相差不大,价格更是低一大截,也仍然难登三甲医院之堂。
张晓华曾去深圳一家生产彩超设备的企业调研,为他们对产品的高要求震惊。“他们(产品)铝合金的柱子不仅是外部,连内部这个我们可能一辈子都看不到的地方,也经过了三道工序处理。如果不处理,虽然并不影响其强度,但内部会被氧化。无论是产品的质量还是工序的严谨,他们都不弱于国外产品。”
虽然其产品的技术指标与国外的同类设备相比还有一些差异,但这种差别和常规的医疗诊断无关,不会对患者有任何影响。
然而,这家企业进三甲医院并非易事。张晓华说:“深圳很多质量过硬的医疗器械产品出口到了美日等发达国家,反而进不去本地的医院。有些医生对国产产品的性能十分清楚,可有些医生没有用过,第一反应就是排斥。”
他补充道,有些医院还有一种错误观点。“如果买了外企的设备,那么手术如果出现任何问题,可以推说是别的原因;要是用的是国产设备,院长就会被怀疑是不是拿回扣了。”
技术出错或超前都成难题
技术不仅将很多跃跃欲试的后来者拦在了门外,也可能让一些企业的研发项目增加了胎死腹中的风险。
普罗惠仁是深圳一家研发生产无创治疗设备的公司。其首席创新官黄汉年对本报记者表示,医疗器械尤其是治疗型的医疗器械产品在研发的方向或技术上出错,产品上市或进入临床的时间可能会耽误三五年。
黄汉年补充道,一旦在设计或者方向上出现失误乃至错误,需要重新设计或大幅更改,随之动物实验和临床试验都要从头再来,这样好几年的时间就过去了。“这不像研发手机,今天发现做错了,明天就可以纠正过来。”
普罗惠仁成立于2003年。与大多数的无创治疗设备生产企业不同,它们的无创治疗并非停留在浅表,而是力图透过皮肤与肌肉层直接进入到人体组织的特定部位,实现内脏病变组织的精准治疗,比如说癌症。不过,目前该技术乃至整个行业在国内外均处于起步阶段。
目前,除了专注妇科治疗的子宫肌瘤治疗设备以外,他们也研发出了一款针对胰腺癌以及一款针对肛肠部位肿瘤的治疗设备,目前尚处于临床试验阶段,反馈情况良好。
即便设备和技术超前,新产品入市后企业如何和医院在技术认知上衔接到位,也是一个莫大的挑战。
一位曾在深圳医疗器械行业工作过多年的人士赵明(化名)对本报记者表示,深圳以前有家公司研发出了一款动态心电图监测设备,在全球来说都算是很早的,他们的产品能克服以前静态心电图的弊端。“以前那种静态心电图,人只要一起一坐,心电图就乱了,质量也差,很多异常看不出来。”
这家公司虽然对心电图设备的质量信心满满,但是市场很快给他们泼了一盆冷水。“因为当时的医生看不明白,医生已经习惯了看人在静态时候的心电图。”
临床试验的漫长等待
除了核心技术这个各行业发展的共性问题外,对于普罗惠仁来说,更让他们曾经头疼的是漫长的临床试验。
该公司研发的超声聚焦治疗子宫肌瘤系统临床验证从2008年开始,一直持续到2011年。其间,他们进行了两期临床试验,病症包括子宫肌瘤、子宫腺肌症等多种妇科肿瘤疾病,共1000多个病例。
对于处于初创期的企业来说,漫长的临床试验无疑是个煎熬。除了忐忑不安地等待试验结果,还要不断狠心往里投钱。
黄汉年感慨,项目超级“烧钱”,他们的子宫肌瘤治疗系统的临床试验前后差不多花了4000万元。

对于很多医疗企业来说,从对病症的筛选,到结束治疗后的临床观察,其间每一个环节钱都在哗哗地往外流。如果没有雄厚的资金实力,普通企业弱小的肩膀根本扛不住。
本报记者到访普罗惠仁的时候,正碰到两位投资人走进该司负责人张激的办公室。事后张激颇为自豪地向记者表白“不缺钱”——在创办企业之初他就拉了两个合伙人一起干,一路走来不停地有新股东加入,最多的时候有16位。上个月,当地一家风投注入的1亿元资金也如期到账。
“若市场上已经有同类产品研发出来并销售,那么你去申请人体试验,就有了对照物,需要做的病例就会少很多,很可能只要大半年就能完成试验。”王筱毅解释说,“不过,如果你的产品是全新的,市场上没有先例,那么人体试验持续个两三年太正常不过了。”
得之不易的注册证
王筱毅的企业生产的是诊断设备,此前花了一年的时间才拿到医疗器械注册证。医疗器械注册证(下称“注册证”)是该行业的市场准入“通行证”,拿不到无法上市销售。
我国按照安全性等级把医疗器械分为三类,由不同的药监部门进行审查管理,类别越高,注册审批与管理越严。根据2014年施行的《医疗器械监督管理条例》(下称《条例》)规定,对第二、三类医疗器械实行产品注册管理。
在全球,医疗器械行业都有市场准入的问题。在欧盟必须通过CE认证,在美国是FDA;在中国必须拿到注册证,此外还有生产许可证,不过后者要相对简单很多,主要看制造环节的生产条件和质量管理体系。
由于治疗设备的产品使用风险比诊断设备高出一大截,企业要拿到注册证,一年时间远远不够。
张激所在的普罗惠仁自创办到证件到手,花了八九年。据他介绍,目前全国做他们类似产品的企业,仅有3家拿到该类型治疗设备的注册证,就算在全球来说也不超过五家。
“因为医疗涉及的潜在风险太高,政府主管部门不可能轻易地批准。很多企业即便已做了临床试验,也拿不到这个证。”他说,注册证对临床要求非常高,包括要做多少例的临床、治疗后的相关指标是否达到标准等等。
前期的严格管控,对这些企业来说,是忧,也是喜。一旦产品一路过关进入市场,质量遭市场质疑的可能性就小得多。
由于设备质量过硬,张激的企业在沉寂十年后,已经感受到了市场爆发的力量。
产品自2014年量产后市场迅速打开,去年生产的30多台设备绝大部分进了国内的三甲医院,还有3台出口至韩国。今年他们预计销售额将增长3倍,目前正在加班加点扩大产能。
激励和监管都在强化
上述企业迈向市场的步伐恰逢其时。从2014年开始,政策的暖风一波接一波地吹来。
2014年3月底,新修订的《条例》公布。《条例》对医疗器械按照风险程度实行分类管理,按风险从低到高将医疗器械分为一、二、三类。其中,第一类医疗器械改为产品备案管理,第二类、第三类医疗器械继续实施产品注册管理。
此外,《条例》也鼓励医疗器械的研究与创新,明确实施“先产品注册,后生产许可”的新监管模式。
随后,国家卫生和计划生育委员会也委托中国医学装备协会启动第一批优秀国产医疗设备产品遴选工作,这对于优秀的国内医疗器械企业来说是个重大的机遇。
2015年5月,卫计委公布了首批95个优秀国产医疗设备名单,台式彩色多普勒超声波诊断仪、数字化X光机和全自动生化分析仪等3种具有一定市场占有率和竞争力、符合基层需要的适宜设备入选。
同月,《中国制造2025》战略出台,要求“大力推动重点领域突破发展”,提及的十大领域就包括高性能医疗器械。该战略还提出,要提高医疗器械的创新能力和产业化水平,重点发展影像设备、医用机器人等高性能诊疗设备,全降解血管支架等高值医用耗材,可穿戴、远程诊疗等移动医疗产品。
与此同时,行业监管的力度也越来越大。2013年,国家食品药品监督管理总局组建成立,并全面启动了机构改革工作,医疗器械监管机构设置和人员配备得以完善和充实。食药监总局成立了医疗器械注册管理司和医疗器械监管司,分别负责医疗器械上市前和上市后的监管。
一个突出的变化是,医疗器械的监管正从生产环节向流通环节扩展,逐步实现全程化。今年6月,食药监总局发布2016年第112号公告,决定对医疗器械流通领域违法经营行为开展集中整治。
身处行业协会的张晓华对此深有体会。他说,以前药监系统对生产管得多,尤其是生产前的产品注册环节,重注册轻监管,对企业的经营环节管理很松。2000年左右才开始要求企业有质量管理体系。但是,“一个产品要安全有效,如果在流通环节做不到控制,很难保证产品安全有效”。“就拿以前被划到药品的试剂来说,需要冷链运输,储存和运输条件非常关键。”张晓华说。
在杜臻雁看来,随着监管越来越严格,未来会有一批劣质的小公司死去,整个行业的集中度将会提升。未来,行业重塑可期。
信息来源:第一财经
 The 82th China International Medicinal Equipment Fair (CMEF)
The 82th China International Medicinal Equipment Fair (CMEF)